La grave sindrome respiratoria acuta coronavirus 2 (SARS-CoV-2) causa la malattia infettiva COVID-19, che è stata segnalata per la prima volta a Wuhan, in Cina, nel dicembre 2019. Nonostante gli enormi sforzi per controllare la malattia, COVID-19 si è ora diffuso a oltre 100 paesi e ha causato una pandemia globale. Si ritiene che SARS-CoV-2 sia nato in pipistrelli; tuttavia, le fonti animali intermedie del virus sono completamente sconosciute. Qui, abbiamo studiato la suscettibilità di furetti e animali a stretto contatto con l’uomo a SARS-CoV-2. Abbiamo scoperto che SARS-CoV-2 si replica male nei cani, nei maiali, nei polli e nelle anatre, ma furetti e gatti sono permissivi all’infezione. Abbiamo scoperto sperimentalmente che i gatti sono sensibili all’infezione nell’aria. Il nostro studio fornisce importanti spunti sui modelli animali per SARS-CoV-2 e sulla gestione degli animali per il controllo COVID-19.
ARTICOLO IN ORIGINALE IN LINGUA INGLESE
Alla fine di dicembre 2019, un’insolita polmonite è emersa negli esseri umani a Wuhan, in Cina, e si è diffusa rapidamente a livello internazionale, sollevando preoccupazioni globali per la salute pubblica. Il patogeno causale è stato identificato come un nuovo coronavirus (1–16) che è stato nominato Sindrome respiratoria acuta grave Coronavirus 2 (SARS-CoV-2) sulla base di un’analisi filogenetica dei coronavirus correlati dal Gruppo di studio del Coronavirus dell’International Committee on International Committee on Tassonomia dei virus (17); la malattia che causa è stata successivamente designata COVID-19 dall’Organizzazione mondiale della sanità (OMS). Nonostante gli enormi sforzi per controllare l’epidemia di COVID-19, la malattia si sta ancora diffondendo. Dall’11 marzo 2020 sono state segnalate infezioni da SARS-CoV-2 in oltre 100 paesi e sono stati confermati 118.326 casi umani, con 4.292 decessi (18). COVID-19 è stato ora annunciato come una pandemia dall’OMS.
Sebbene SARS-CoV-2 condivida l’identità del 96,2% a livello di nucleotidi con il coronavirus RaTG13, che è stato rilevato nei pipistrelli a ferro di cavallo (Rhinolophus spp) nella provincia di Yunnan nel 2013 (3), non è stato precedentemente rilevato nell’uomo o in altri animali. La situazione emergente solleva molte domande urgenti. I virus ampiamente diffusi potrebbero trasmettere ad altre specie animali, che diventano quindi riserve di infezione? L’infezione da SARS-CoV-2 ha un ampio spettro clinico nell’uomo, dall’infezione lieve alla morte, ma come si comporta il virus in altri animali? Man mano che vengono compiuti sforzi per lo sviluppo di vaccini e farmaci antivirali, quali animali possono essere utilizzati in modo più preciso per modellare l’efficacia di tali misure di controllo nell’uomo? Per rispondere a queste domande, abbiamo valutato la suscettibilità di diversi animali da laboratorio modello, nonché di animali da compagnia e domestici a SARS-CoV-2.
Tutti gli esperimenti con SARS-CoV-2 infettiva sono stati condotti nelle strutture di livello 4 di biosicurezza e livello 4 di biosicurezza animale presso l’Istituto di ricerca veterinaria di Harbin (HVRI) dell’Accademia cinese di scienze agrarie (CAAS), che è stato approvato per tale uso dal Ministero dell’Agricoltura e degli affari rurali della Cina. I dettagli delle misure di biosicurezza e biosicurezza adottate sono forniti nei materiali supplementari (19). I protocolli per lo studio e il benessere degli animali sono stati rivisti e approvati dal comitato per l’etica degli esperimenti sugli animali dell’HVRI del CAAS (numero di approvazione 2020-01-01JiPi).
I furetti sono comunemente usati come modello animale per i virus respiratori che hanno infettato l’uomo (20-26). Abbiamo quindi testato la suscettibilità di SARS-CoV-2 nei furetti. Due virus [SARS-CoV-2 / F13 / environment / 2020 / Wuhan, isolati da un campione ambientale raccolto nel mercato ittico di Huanan a Wuhan (F13-E) e SARS-CoV-2 / CTan / human / 2020 / Wuhan (CTan-H), isolato da un paziente umano] sono stati utilizzati in questo studio. Coppie di furetti sono state inoculate per via intranasale con 105 unità formanti placca (PFU) rispettivamente di F13-E o CTan-H ed eutanizzate il giorno 4 post-inoculazione (p.i.). Il turbinato nasale, il palato molle, le tonsille, la trachea, il polmone, il cuore, il fegato, la milza, i reni, il pancreas, l’intestino tenue e il cervello di ciascun furetto sono stati raccolti per la quantificazione dell’RNA virale mediante qPCR e titolazione del virus nelle cellule Vero E6. L’RNA virale (Fig. 1, A e B) e il virus infettivo sono stati rilevati nel turbinato nasale, nel palato molle e nelle tonsille di tutti e quattro i furetti inoculati con questi due virus, ma non sono stati rilevati in nessun altro organo testato (Fig. 1, C e D). Questi risultati indicano che SARS-CoV-2 può replicarsi nel tratto respiratorio superiore dei furetti, ma la sua replicazione in altri organi non è rilevabile.
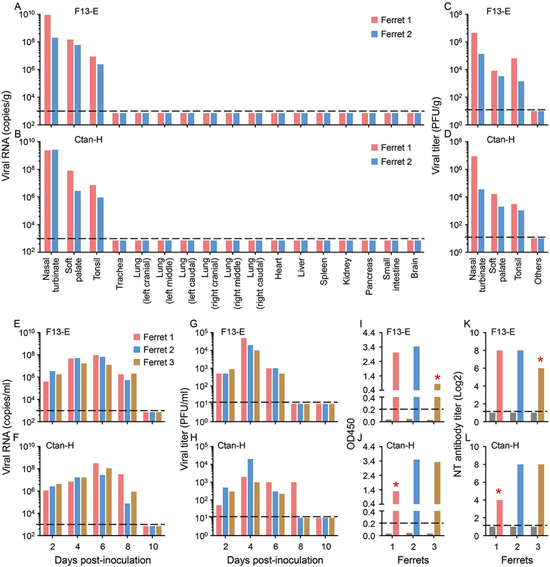
Per studiare la dinamica di replicazione di questi virus nei furetti, gruppi di tre animali sono stati inoculati per via intranasale con 105 PFU di F13-E o CTan-H, e quindi collocati in tre gabbie separate all’interno di un isolatore. I lavaggi nasali e i tamponi rettali sono stati raccolti nei giorni 2, 4, 6, 8 e 10 p.i. dai furetti per il rilevamento dell’RNA virale e la titolazione del virus. La temperatura corporea e i segni della malattia sono stati monitorati per due settimane. Come mostrato in Fig. 1, l’RNA virale è stato rilevato nei lavaggi nasali nei giorni 2, 4, 6 e 8 p.i. in tutti e sei i furetti inoculati con i due virus (Fig. 1, E e F). L’RNA virale è stato anche rilevato in alcuni dei tamponi rettali dei furetti inoculati da virus sebbene i numeri delle copie fossero notevolmente più bassi di quelli nei lavaggi nasali di questi furetti (fig. S1, A e C). Il virus infettivo è stato rilevato dai lavaggi nasali di tutti i furetti (Fig. 1, G e H), ma non dai tamponi rettali di qualsiasi furetto (fig. S1, B e D).
Un furetto di ciascun gruppo inoculato con virus ha sviluppato febbre e perdita di appetito nei giorni 10 e 12 giorni rispettivamente. Per indagare se questi sintomi erano causati dalla replicazione del virus nel tratto respiratorio inferiore, abbiamo eliminato i due furetti il giorno 13 p.i. e raccolto i loro organi per il rilevamento dell’RNA virale. Tuttavia, l’RNA virale non è stato rilevato in nessun altro tessuto o organo di nessuno dei due furetti, ad eccezione di un numero di copie basso (105,4 copie / g) nel turbinato del furetto inoculato con CTan-H (fig. S2). Studi patologici hanno rivelato perivasculite linfoplasmatica grave e vasculite, aumento del numero di pneumociti di tipo II, macrofagi e neutrofili nei setti alveolari e nel lume alveolare e lieve peribronchite nei polmoni dei due furetti eutanizzati il giorno 13 p.i. (fig. S3). Anticorpi contro SARS-CoV-2 sono stati rilevati in tutti i furetti da un ELISA e da un test di neutralizzazione, sebbene i titoli anticorpali dei due furetti che sono stati eutanizzati il 13 ° giorno p.i. erano notevolmente inferiori a quelli dei furetti eutanizzati il giorno 20 p.i. (Fig. 1, da I a L).
Un saggio di attacco del virus ha indicato che SARS-CoV-2 potrebbe legarsi alle cellule epiteliali bronchiolari (fig. S4A) e ad alcuni pneumociti di tipo II (fig. S4B) nel polmone del furetto. Per indagare ulteriormente se SARS-CoV-2 si replica nei polmoni dei furetti, abbiamo inoculato per via intratracheale otto furetti con 105 PFU di CTan-H, e abbiamo eutanizzato due animali ciascuno nei giorni 2, 4, 8 e 14 p.i. cercare l’RNA virale nei tessuti e negli organi. L’RNA virale è stato rilevato solo nel turbinato nasale e nel palato molle di uno dei due furetti che sono stati eutanizzati nei giorni 2 e 4 p.i .; nel palato molle di un furetto e nel turbinato nasale, palato molle, tonsille e trachea dell’altro furetto che sono stati eutanizzati l’8 giorno p .; e non è stato rilevato in nessuno dei due furetti che sono stati eutanizzati il giorno 14 p.i. (fig. S5). Questi risultati indicano che SARS-CoV-2 può replicarsi nel tratto respiratorio superiore dei furetti per un massimo di otto giorni, senza causare gravi malattie o morte.
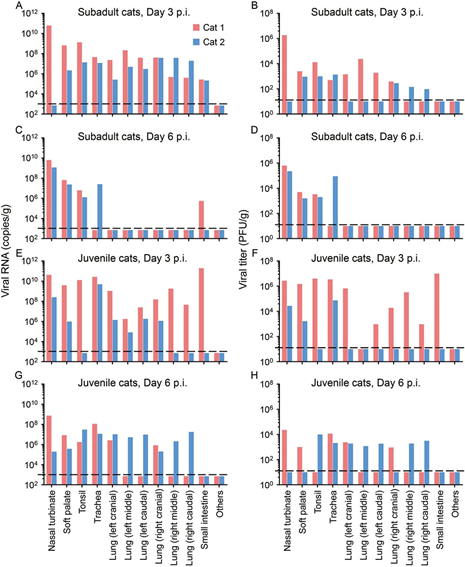
Cani e gatti sono a stretto contatto con l’uomo, quindi è importante capire la loro suscettibilità a SARS-CoV-2 per il controllo COVID-19. Abbiamo prima studiato la replicazione di SARS-CoV-2 nei gatti. Sette gatti subadulti (di età compresa tra 6-9 mesi, gatti domestici di razza) sono stati inoculati per via intranasale con 105 PFU di CTan-H. Due animali erano programmati per essere eutanizzati nei giorni 3 p.i. e 6 p.i., rispettivamente, per valutare la replicazione virale nei loro organi. Tre gatti subadulti sono stati collocati in gabbie separate all’interno di un isolatore. Per monitorare la trasmissione delle goccioline respiratorie, un gatto non infetto è stato posto in una gabbia adiacente a ciascuno dei gatti infetti. È stato difficile eseguire una raccolta regolare di lavaggio nasale sui gatti subadulti perché erano aggressivi. Per evitare possibili lesioni, abbiamo raccolto solo feci da questi gatti e controllato l’RNA virale nei loro organi dopo l’eutanasia.
L’RNA virale è stato rilevato nel turbinato nasale di un animale, nei palati molli, nelle tonsille, nelle trachee, nei polmoni e nell’intestino tenue di entrambi gli animali che sono stati eutanizzati il giorno 3 p.i., (Fig. 2A). Negli animali che sono stati eutanizzati il giorno 6 p.i., l’RNA virale è stato rilevato nei turbinati nasali, nei palati molli e nelle tonsille di entrambi gli animali, nella trachea di un animale e nell’intestino tenue dell’altro; tuttavia, l’RNA virale non è stato rilevato in nessuno dei campioni polmonari di nessuno di questi animali (Fig. 2C). Il virus infettivo è stato rilevato nei turbinati nasali positivi all’RNA virale, nei palati molli, nelle tonsille, nelle trachee, nei polmoni di questi gatti, ma non è stato recuperato dall’intestino tenue virale positivo all’RNA (Fig. 2, B e D)
Nello studio sulla trasmissione, l’RNA virale è stato rilevato nelle feci di due gatti subadulti inoculati da virus il giorno 3 p.i. e in tutti e tre i gatti subadulti inoculati da virus il giorno 5 p.i. (Fig. 3A). L’RNA virale è stato rilevato nelle feci di un gatto esposto il giorno 3 p.i. (Fig. 3A). La coppia di gatti subadulti con feci virali positive all’RNA è stata eutanizzata l’11 ° giorno pi e l’RNA virale è stato rilevato nel palato molle e nelle tonsille dell’animale inoculato da virus e nel turbinato nasale, palato molle, tonsille e trachea della animale esposto (Fig. 3B), indicando che in questa coppia di gatti era avvenuta la trasmissione di goccioline respiratorie. Abbiamo eutanizzato le altre coppie di animali il giorno 12 pi, e l’RNA virale è stato rilevato nelle tonsille di un gatto subadulto inoculato da virus, nel turbinato nasale, nel palato molle, nelle tonsille e nella trachea dell’altro gatto subadulto inoculato da virus, ma non è stato rilevato in nessun organo o tessuto dei due gatti subadulti esposti (Fig. 3B). Sono stati rilevati anticorpi contro SARS-CoV-2 in tutti e tre i gatti subadulti inoculati da virus e in un gatto esposto mediante un test ELISA e di neutralizzazione (Fig. 3, C e D).
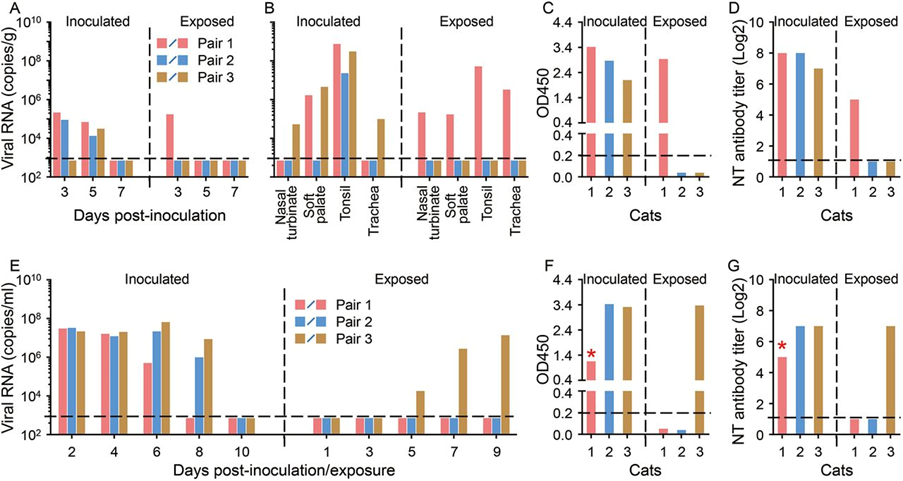
Abbiamo replicato gli studi di replicazione e trasmissione nei gatti giovani (di età compresa tra 70 e 100 giorni) (Figg. 2, da E a H e 3, da E a G e fig. S6). Studi istopatologici condotti su campioni di gatti giovani inoculati da virus che sono morti o eutanizzati il 3 ° giorno p.i. ha rivelato lesioni enormi negli epitelio della mucosa nasale e tracheale e nei polmoni (fig. S7). Questi risultati indicano che SARS-CoV-2 può replicarsi efficacemente nei gatti, con i gatti più giovani che sono più permissivi e, forse ancora più importante, il virus può trasmettere tra i gatti attraverso la via aerea.
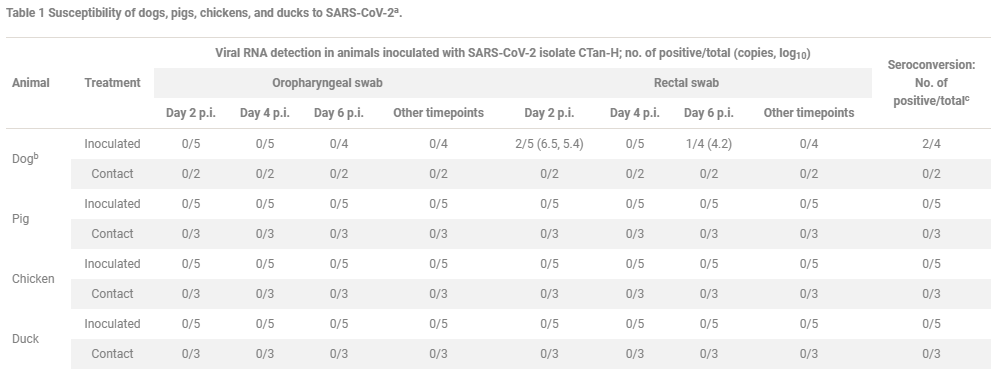
Successivamente abbiamo studiato la replicazione e la trasmissione di SARS-CoV-2 nei cani. Cinque beagle di 3 mesi sono stati inoculati per via intranasale con 105 PFU di CTan-H, e alloggiati con due beagle non inoculati in una stanza. I tamponi orofaringei e rettali di ciascun beagle sono stati raccolti nei giorni 2, 4, 6, 8, 10, 12 e 14 p.i., per il rilevamento dell’RNA virale e la titolazione del virus nelle cellule Vero E6. L’RNA virale è stato rilevato nei tamponi rettali di due cani inoculati da virus il giorno 2 p.i. e nel tampone rettale di un cane il giorno 6 p.i. (Tabella 1). Un cane che era positivo all’RNA virale dal suo tampone rettale il giorno 2 p.i. è stato eutanizzato il giorno 4 p.i., ma l’RNA virale non è stato rilevato in nessun organo o tessuto raccolto da questo cane (fig. S8). Il virus infettivo non è stato rilevato in nessun tampone raccolto da questi cani. I sieri sono stati raccolti da tutti i cani il giorno 14 p.i. per il rilevamento di anticorpi mediante l’uso di un ELISA. Due cani inoculati da virus sieroconvertiti; gli altri due cani inoculati da virus e i due cani da contatto erano tutti sieronegativi per SARS-CoV-2 secondo ELISA (Tabella 1 e fig. S9). Questi risultati indicano che i cani hanno una bassa suscettibilità alla SARS-CoV-2
b Un beagle inoculato con virus è stato eutanizzato il giorno 4 pi, ma l’RNA virale non è stato rilevato in nessuno dei suoi organi raccolti, tra cui polmone, trachea, turbinato nasale, palato molle, cervello, cuore, tonsille, reni, milza, fegato, pancreas e intestino tenue (fig. S6).
Il cSera è stato raccolto da tutti gli animali il giorno 14 p.i. e gli anticorpi contro SARS-CoV-2 sono stati rilevati utilizzando un kit ELISA Sandwich doppio antigene (ProtTech, Luoyang, Cina).
.
Abbiamo anche studiato la suscettibilità di suini, polli e anatre a SARS-CoV-2 usando la stessa strategia usata per valutare i cani; tuttavia, l’RNA virale non è stato rilevato in nessun tampone raccolto da questi animali inoculati da virus o da animali a contatto ingenuo (Tabella 1) e tutti gli animali erano sieronegativi per SARS-CoV-2 quando testati utilizzando l’ELISA con sieri raccolti su giorno 14 pi (Tabella 1). Questi risultati indicano che i maiali, i polli e le anatre non sono sensibili alla SARS-CoV-2.
In sintesi, abbiamo scoperto che furetti e gatti sono altamente sensibili alla SARS-CoV-2, i cani hanno una bassa suscettibilità e il bestiame tra cui maiali, galline e anatre non è sensibile al virus.
I furetti sono stati spesso usati come modello animale per lo studio dei virus respiratori umani (20-26). A differenza dei virus influenzali e di altri SARS-coronavirus umani, che si replicano nel tratto respiratorio superiore e inferiore dei furetti (20, 22-24, 26, 27), abbiamo scoperto che SARS-CoV-2 si replica solo nel turbinato nasale, nel palato molle e tonsille di furetti. Può anche replicarsi nel tratto digestivo, poiché l’RNA virale è stato rilevato nei tamponi rettali dei furetti infetti da virus, ma il virus non è stato rilevato nei lobi polmonari, anche dopo che i furetti sono stati inoculati per via intratracheale con il virus. Non è chiaro se il virus causi una malattia più grave nei furetti maschili rispetto ai furetti femminili, come è stato osservato tra gli umani (13, 28).
Diversi studi hanno riportato che SARS-CoV-2 utilizza l’enzima 2 di conversione dell’angiotensina (ACE2) come recettore per entrare nelle cellule (3, 29–31). L’ACE2 è principalmente espresso in pneumociti di tipo II e cellule epiteliali sierose delle ghiandole sottomucose tracheo-bronchiali nei furetti (25). Furetti e gatti hanno solo due differenze di aminoacidi nelle regioni a contatto di picchi SARS-CoV-2 di ACE2 (tabella S1); pertanto, resta da studiare il meccanismo sottostante che impedisce la replicazione della SARS-CoV-2 nel tratto respiratorio inferiore dei furetti. Il fatto che SARS-CoV-2 si replica in modo efficiente nel tratto respiratorio superiore dei furetti li rende un modello animale candidato per la valutazione di farmaci antivirali o candidati vaccinali contro COVID-19.
I gatti che abbiamo usato in questo studio erano di razza superiore ed erano sensibili alla SARS-CoV-2, che si replicava in modo efficiente e si trasmetteva ai gatti ingenui. È stato segnalato che i gatti di Wuhan sono sieropositivi per SARS-CoV-2 (32). La sorveglianza per SARS-CoV-2 nei gatti deve essere considerata in aggiunta all’eliminazione di COVID-19 nell’uomo.

No responses yet